Desvendando mecanismos de tumorigênese na Leucemia Mielóide Crônica
Introdução e histórico
A leucemia mielóide crônica (LMC) consiste em um câncer das células brancas no sangue que comumente acomete a população adulta e idosa. A LMC foi o primeiro câncer associado a uma anormalidade genética, conhecida pela presença do cromossomo Philadelphia (Ph).
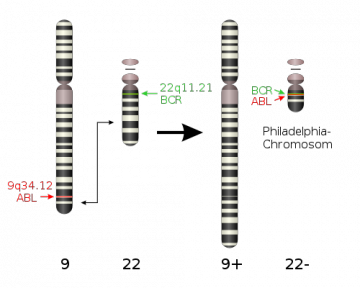
A descoberta de que a troca de material genético entre os cromossomos 9 e 22 resulta na formação do cromossomo Philadelphia consiste em um importante marco para a patogênese da LMC. Durante sua formação, os genes c-abl (cromossomo 9) e bcr (cromossomo 22) sofrem quebras em regiões específicas. A justaposição entre tais genes no cromossomo Philadelphia dão origem à enzima Bcr-Abl que possui atividade tirosina cinase desregulada. Nesse cenário, ocorre a perda do controle celular e a formação de células resistentes à morte celular programada (apoptose), que culminam no câncer.
Figura 1: Formação do cromossomo Philadelphia.
(Obtida a partir do site da wikipedia.)
Na década de 90, um novo inibidor de tirosina cinases conhecido por STI-571 (imatinibe ou Gleevec) foi testado contra células Bcr-Abl positivas. Desde então, esse fármaco vem sendo utilizado como linha de frente para o tratamento da LMC, elevando a sobrevida dos pacientes. Entretanto, diversos relatos de resistência ao medicamento foram reportados, o que levou a busca de novos fármacos capazes de inibir a enzima Bcr-Abl em sítios alternativos ao sítio catalítico.
Nosso trabalho
Com o objetivo de melhor compreender os mecanismos envolvidos no controle celular por parte da proteína c-Abl normal o grupo de pesquisa comandado pelo professor Jerson Lima da Silva, do Instituto de Bioquímica Médica (UFRJ), utilizou diversas técnicas modernas, tais como (i) estratégias de espalhamento de raios-X a baixos ângulos, (ii) ressonância magnética nuclear e (iii) microscopia confocal, para investigar a dinâmica da unidade regulatória dessa proteína.
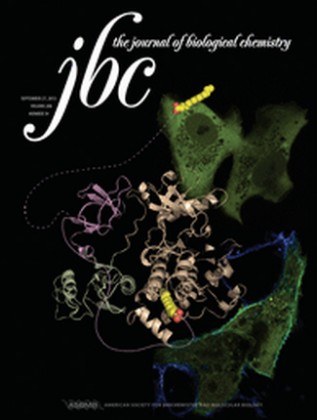
Figura 2: A capa do periódico JBC de 27/09/13 destaca o trabalho de Oliveira et al. A versão miristoilada de c-Abl (verde) colocaliza (cyan) com a membrana plasmática. O N-cap-miristoil teter (linha rosa sólida) é mostado na estrutura cristalográfica de c-Abl ligado ao C-terminal do domínio catalítico (marrom claro) e liberado desse complexo (linha rosa pontilhada) para ancorar na membrana.
Tais estudos revelaram que a ativação da c-Abl promove a liberação de interações intramoleculares entre uma região regulatória localizada em seu N-terminal (N-Cap) e outros domínios da proteína, que a direcionam para o ancoramento na membrana plasmática. Foi observado também que o ancoramento em regiões de membrana está associado ao processo de morte celular desencadeado pela c-Abl. O estudo destaca que, na ausência da região do N-Cap, como ocorre na variante Philadelphia Bcr-Abl, as células escapam do processo de apoptose, mecanismo responsável pela morte celular. Sem este processo natural, as células se tornam imortais e o câncer é instalado.
Conclusões
Essas descobertas podem auxiliar nas pesquisas da LMC uma vez que, em células leucêmicas resistentes a apoptose, o Bcr-Abl está espalhado pelo citoplasma e não é detectado em regiões de membrana -- como observado para a forma normal da c-Abl. De acordo com o pesquisador Guilherme A. P. de Oliveira, primeiro autor do estudo, “nossos resultados indicam que a unidade regulatória da c-Abl está envolvida com a correta localização da enzima na célula, podendo ditar o destino da mesma.”
O trabalho intitulato “Intramolecular dynamics within the N-Cap-SH3-SH2 regulatory unit of the c-Abl tyrosine kinase reveal targeting to the cellular membrane” foi escolhido como “paper of the week” na revista “The Journal of Biological Chemistry” e foi destacado na capa da edição de 27 de setembro de 2013.
Figura 3: Revista internacional destaca esta publicação como um dos 3 principais trabalhos publicados na semana.
- Leia o editorial que contém a chamada para o artigo na revista.
- Acesse também o artigo completo no site da JBC.
Referência completa para citação:
- de Oliveira GA, Pereira EG, Ferretti GD, Valente AP, Cordeiro Y, Silva JL. Intramolecular Dynamics within the N-Cap-SH3-SH2 Regulatory Unit of the c-Abl Tyrosine Kinase Reveal Targeting to the Cellular Membrane. J Biol Chem. 2013 Sep 27;288(39):28331-45. doi: 10.1074/jbc.M113.500926. Epub 2013 Aug 8.

 Jerson Lima Silva recebeu o título de Doutor em Biofísica no ano de 1987 (Instituto de Biofísica, UFRJ). É Professor Titular no Instituto de Bioquímica Médica da UFRJ. Jerson Lima Silva também atua como Diretor Científico da Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de Janeiro desde 2003. Tornou-se professor titular do Instituto de Bioquímica Médica em 1997 e Diretor do Centro Nacional de Ressonância Magnética Nuclear Jiri Jonas em 1998. É pesquisador ...
Jerson Lima Silva recebeu o título de Doutor em Biofísica no ano de 1987 (Instituto de Biofísica, UFRJ). É Professor Titular no Instituto de Bioquímica Médica da UFRJ. Jerson Lima Silva também atua como Diretor Científico da Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de Janeiro desde 2003. Tornou-se professor titular do Instituto de Bioquímica Médica em 1997 e Diretor do Centro Nacional de Ressonância Magnética Nuclear Jiri Jonas em 1998. É pesquisador ...