A automontagem de capsídeos do vírus da hepatite C pode revelar novos mecanismos etiológicos da doença
Em 9 de Novembro de 2016, o periódico PeerJ publicou um estudo intitulado ”Charge neutralization as the major factor for the assembly of nucleocapsid-like particles from C-terminal truncated hepatitis C virus core protein” que traz um relato sobre a formação das partículas do vírus da Hepatite C. O vírus causa uma virose que acomete aproximadamente 200 milhões de pessoas em todo o mundo.
Em sua fase crônica, o vírus da Hepatite C é capaz de causar cirrose no paciente ou até mesmo um carcinoma hepatocelular (CHC). Assim, ele acabou se tornando a principal causa de transplante de fígado no mundo! Por isso, a compreensão dos processos, da dinâmica e dos mecanismos envolvidos nesta patogênese pode ajudar no desenvolvimento de novos tratamentos antivirais para a população afetada.
O novo estudo do grupo de cientistas liderado pela Profa. Andrea Cheble (IBqM) buscou novas informações sobre a estrutura e a termodinâmica da proteína capsídica do vírus da Hepatite C (HCV124).
HCV124
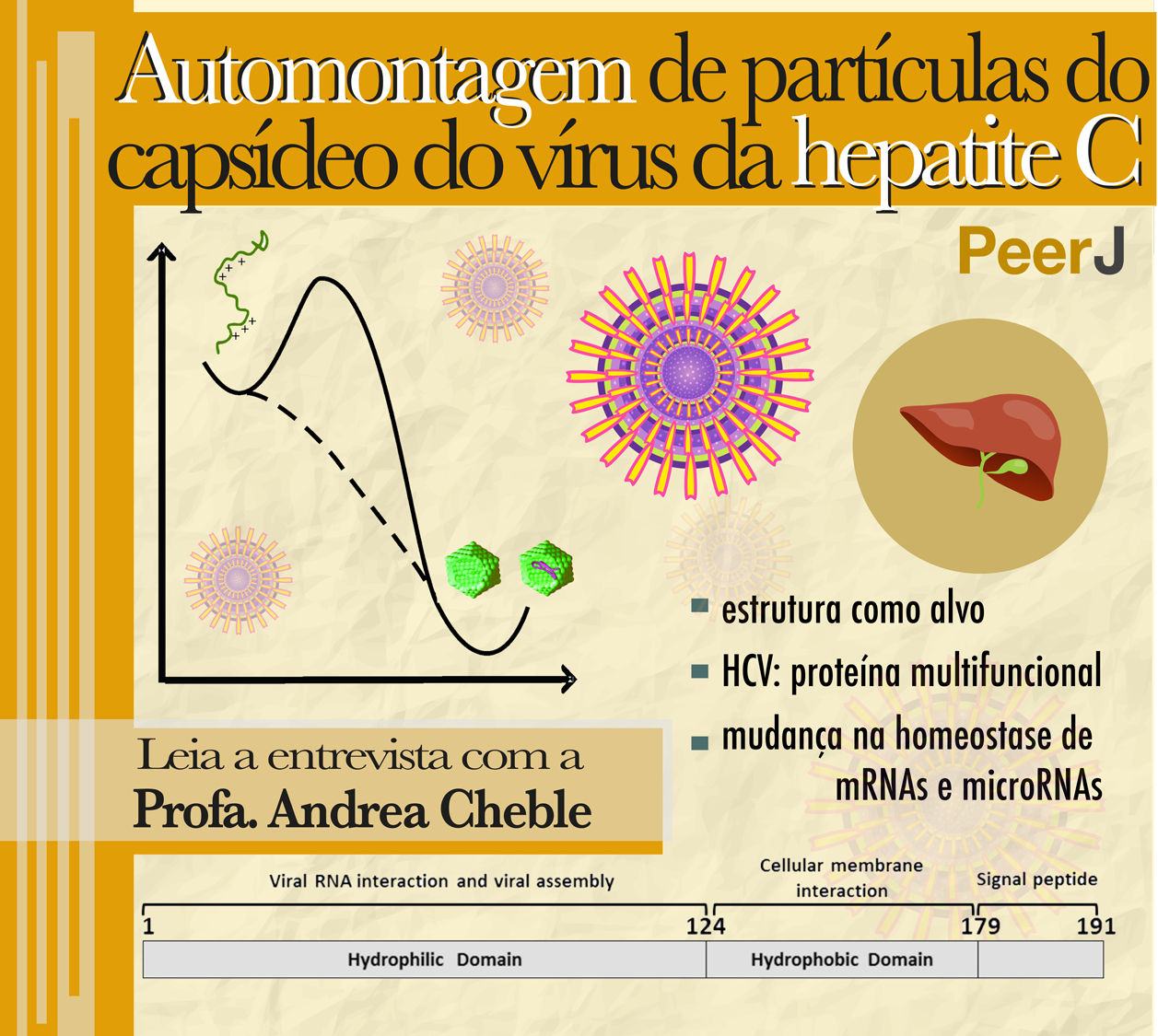
A proteína HCV124 tem sido um alvo crítico em estudos que tentam conter a replicação viral. Além de ser importante para formação do nucleocapsídeo e para a proteção do genoma viral, ela está envolvida também em processos celulares da patogênese, na homeostase de RNAm e na interação com ácidos nucleicos.
A ideia do trabalho foi conhecer novos aspectos moleculares da região inicial dessa proteína (N-terminal), que é descrita como intrinsecamente desordenada. Os cientistas do IBqM mostraram que essa região realmente não possui uma predisposição para se estruturar. Entretanto, curiosamente, na ausência de ácidos nucleicos e, mesmo em baixas concentrações, ela é capaz de se multimerizar em NLPs (partículas semelhantes ao capsídeo viral) vazias quando o pH está próximo ao seu ponto isoelétrico (pH 12). Isso pode sugerir que a montagem do genoma viral seja principalmente conduzida através da neutralização de cargas.
A Profa. Andrea Cheble aceitou gentilmente o convite do nosso Portal para responder algumas questões sobre seu trabalho publicado!
PORTAL BIOQMED. Bom dia, Profa. Andrea! Agradecemos por aceitar nosso convite! Sabe-se que a região N-terminal da proteína HCV124 tem sido descrita como intrinsecamente desordenada. Há uma correlação entre estrutura e função nesta proteína? Vocês investigaram conseguiram encontrar novas características estruturais ou dinâmicas nessa proteína que poderiam estar relacionadas às suas múltiplas funções?
PROFESSORA ANDREA CHEBLE. Bom dia, Larissa! Eu também agradeço o interesse pelo nosso trabalho. Temos estudado a proteína capsídica do vírus da Hepatite C há alguns anos e ficamos muito satisfeitos com o resultado dessa parte do estudo!
A Hepatite C é uma doença grave, silenciosa e um grande problema de saúde pública. Não há uma vacina contra o HCV, porém, muitas terapias antivirais vêm sendo desenvolvidas com bastante sucesso, tendo havido um enorme avanço recentemente em termos da eficácia e diminuição dos efeitos colaterais, que eram a principal causa de desistência do tratamento por parte dos pacientes. Muitas dessas terapias estão voltadas para a inibição das proteínas virais. Portanto, a compreensão acerca dessas proteínas tem sido de crucial importância para esse desenvolvimento. Comparado a outros vírus, o HCV é um vírus difícil de estudar devido à dificuldade de encontrar modelos de infecção tanto de células quanto de animais. Além disso, sua estrutura ainda não foi determinada em nível atômico, e, portanto, outras estratégias vêm sendo utilizadas para agregarmos mais informações a respeito desse vírus tão importante. Uma dessas estratégias é o estudo das proteínas virais isoladas, como foi feito nesse estudo em relação à proteína capsídica.
A proteína capsídica do HCV é uma proteína já descrita como multifuncional e está envolvida não somente na estrutura do capsídeo viral e na proteção do RNA, mas também participa de diversos processos virais e celulares! Tem sido visto que ela é capaz de interagir com diversas proteínas celulares e exercer diferentes funções, o que nos leva a crer que ela é capaz de adotar diferentes conformações quando em contato com seus diferentes alvos. A expressão da proteína recombinante em animais é capaz de induzir carcinoma hepatocelular. Além disso, essa proteína é capaz de promover mudanças na homeostase de mRNAs e microRNAs em hepatócitos, e essa é uma das questões que levantamos quando analisamos nossos dados. Observamos que a C124 tem pouca tendência a se enovelar, porém vemos uma capacidade (não muito esperada na ausência de ligantes e em baixa concentração) de se oligomerizar e montar capsídeos (NLPs) vazios quando em pH próximo a seu ponto isoelétrico. A C124 é capaz também de encapsular um grande número de ácidos nucleicos inespecíficos e formar capsídeos em baixíssimas concentrações. Essas características podem explicar essa multiplicidade de funções e porque a formação de partículas in vitro não necessita de alta especificidade dos ligantes.
PORTAL BIOQMED. O que são as NPLs? Pode nos explicar como funciona o processo de montagem?
PROFESSORA ANDREA. NLPs vêm do inglês “Nucleocapsid-LikeParticles”, ou seja, partículas semelhantes a nucleocapsídeos. Esses são vírus envelopados e, in vitro, estamos trabalhando com as partículas sem o envelope, ou seja, somente com o capsídeo e o material genético heterólogo. Nós já tínhamos observado, para essa forma da proteína -- e outros grupos observaram o mesmo para outras formas -- que essas partículas são capazes de ser formadas na presença de diferentes ácidos nucleicos, gerando partículas com ácidos nucleicos heterólogos. Nesse estudo, utilizamos a proteína C124 recombinante, expressa em bactéria. Nós purificamos e observamos pela primeira vez que, quando incubamos a proteína em pH alcalino, próximo do seu ponto isoelétrico, ela é capaz de multimerizar tanto em NLPs vazias como também com a presença de ácido nucleico. Observamos a montagem do capsídeo por diversas técnicas, tais como: espectrofotometria, espalhamento de luz estático e dinâmico, espectroscopia e microscopia eletrônica. Todas as técnicas nos mostraram que as proteínas montam realmente partículas e não somente agregados amorfos.
PORTAL BIOQMED. Quais os principais resultados obtidos no seu novo estudo? Como essas novas informações podem ser aplicadas?
PROFESSORA ANDREA. O primeiro resultado importante é exatamente o que acabei de descrever, ou seja, nós fizemos a caracterização estrutural da proteína e mostramos que -- pelo menos grande parte dessa forma da proteína-- é de fato intrinsecamente desordenada. Assim, ela pode ser descrita como uma IDP (do inglês, Intrinsically Disordered Protein) e é capaz de automontar capsídeos na ausência de qualquer molécula que funcionaria como uma chaperona da montagem, como, obviamente, moléculas de ácidos nucleicos do mesmo vírus. Isso sugere que a montagem das partículas virais pode ser basicamente dirigida pela neutralização das cargas positivas presentes em grande quantidade nessa proteína (em torno de 20% de resíduos básicos). Isso ajuda a explicar um segundo conjunto de dados que apresentamos e que revelam que essa forma é capaz de sequestrar diversos tipos de ácidos nucleicos de forma inespecífica, em concentração bem baixa, na faixa de nanomolar. Isso foi demonstrado através de análises usando técnicas avançadas de espectroscopia de correlação de fluorescência (FCS).
O que foi interessante notar é que esses ácidos nucleicos utilizados apresentam tamanhos equivalentes a microRNAs celulares, sugerindo a capacidade dessa proteína de interagir com material genético celular! Essas características por nós apresentadas podem explicar a multiplicidade de funções da proteína capsídica do HCV, tais como atuar na regulação gênica. Eles também podem explicar por que a formação de partículas in vitro não requer alta especificidade, sendo principalmente dirigida pela neutralização dos resíduos básicos. Esses dados podem nos esclarecer diversos aspectos da interação entre o vírus e o hospedeiro na patogênese do HCV.
A ausência de uma estrutura rígida globular em condições fisiológicas pode representar uma vantagem funcional importante, permitindo que essa proteína interaja de forma eficiente com diferentes alvos celulares. Verificamos que uma contribuição entálpica negativa é a chave termodinâmica para a montagem dessas partículas.
Além disso, sugerimos que a montagem dessas partículas não requer alta especificidade pelo RNA viral e, embora outros co-fatores não abordados aqui possam estar envolvidos na determinação da especificidade de ligação a RNAs específicos, especulamos que a proteína capsídica possa interagir com poliânions celulares, como por exemplo mRNAs ou microRNAs. Isso levaria ao confinamento dessas moléculas em NLPs ou partículas infecciosas.
A forma e o tamanho dos pequenos RNAs celulares podem ser fatores importantes determinar a afinidade e o empacotamento preferencial deles nos NPLs, levando a um controle seletivo da concentração de microRNAs e mRNAs celulares envelopados.
Já foi demonstrado que há um desbalanço de microRNAs em células infectadas pelo HCV, mas ainda não se conhecem os mecanismos que geram esse desbalanço. Também já foi mostrado que a interação de um microRNA com o genoma do HCV é fundamental para o acúmulo de RNA viral em hepatócitos. Além disso, mostraram que o sequestro desse microRNA pelo RNA viral induz uma ausência de repressão de alvos desse microRNA, favorecendo uma perda da homeostase do fígado e o desenvolvimento de câncer hepático.
Com nosso estudo, sugerimos que a proteína capsídica pode contribuir para essa perda da homeostase de microRNAs por encapsular ácidos nucleicos mais ou menos inespecíficos em partículas infecciosas.
PORTAL BIOQMED. A hepatite C é um problema de saúde que na maioria dos casos ainda não tem cura, portanto, os pacientes afetados pelo vírus recorrem a tratamentos. Como está o atual quadro da população brasileira em relação ao investimento de pesquisa científica e efetividade do tratamento contra o vírus?
PROFESSORA ANDREA. Como dito anteriormente, a hepatite C é um grave problema de saúde pública mundial. O vírus HCV foi descoberto na década de 90, mas somente em 1993 foi que os bancos de sangue passaram a fazer o controle para esse vírus. Como essa é uma doença silenciosa, podendo apresentar suas consequências 20 a 30 anos após a infecção, muitos casos principalmente de pessoas que necessitaram de transfusão de sangue antes disso, estão aparecendo após 20 anos ou mais... E quando a doença é diagnosticada, muitas vezes ela já está em estágio avançado de cirrose ou até já como hepatocarcinoma... e aí a única saída possível é o transplante de fígado.
Em termos de terapia antiviral, tem havido um avanço enorme, principalmente nos últimos três anos. Terapias chamadas de ação direta, totalmente orais e livres de interferon (que era a maior causa dos efeitos colaterais em pacientes em tratamento) têm sido a grande promessa do momento. Muitos indivíduos estão próximos da cura. A redução da carga viral é fantástica! E é também eficiente para todos os genótipos. Além disso, o tempo de tratamento é muito curto sendo que alguns protocolos são completos em 3 meses, e com muito menos efeito colateral.
No panorama nacional da hepatite C, eu diria que hoje estamos muito melhores do que há uns anos atrás. Em 2016, esses medicamentos de ação direta chegaram ao Brasil, beneficiando um número enorme de indivíduos infectados. O governo conseguiu distribuir mais de 40.000 tratamentos, superando a expectativa inicial, e esse foi um avanço indiscutível! O tratamento é priorizado aos pacientes mais graves, com fibrose avançada e cirrose, mas a meta é conseguir tratar inclusive os que apresentam menor dano hepático. Atualmente, o Ministério da Saúde conseguiu disponibilizar testes rápidos em todos os postos e unidades de saúde do Brasil. Campanhas são realizadas para que as pessoas façam exames para verificar se apresentam anticorpos contra o vírus, antecipando o diagnóstico e impedindo que a doença seja descoberta em um estágio crítico e de difícil tratamento. Nesse aspecto, minha visão é que é preciso fazer o diagnóstico do um maior número possível de indivíduos infectados e tentar atrair mais as pessoas para o teste sorológico. A atual meta de Organização Mundial de Saúde é que, em 2030, as hepatites B e C sejam doenças de baixa prevalência e possam ser consideradas doenças raras no mundo. Esperamos contribuir de certa forma para esse cenário.
Já em relação ao investimento em pesquisa científica para a hepatite C, é um cenário atual infelizmente muito desanimador, não somente para essa grave doença, mas de uma forma geral. Existem alguns poucos programas para fomentar pesquisa em doenças estratégicas, emergenciais, como, por exemplo, Zika, pela evidente preocupação atual. Mas a verdade é que a grande maioria das pesquisas está hoje em um momento de escassez de verbas. A comunidade científica tem tentado se mobilizar em diversas frentes na tentativa de mostrar a importância desse fomento, uma vez que alguns laboratórios de pesquisa de ponta estão sendo obrigados a fechar as portas. Porém, temos tentado seguir na medida do possível com os estudos acerca dessa impactante doença. Temos total clareza de que, se houvesse mais suporte financeiro, já estaríamos bem à frente com as nossas pesquisas. Um gargalo importante atualmente é o custo altíssimo desses novos medicamentos que são produzidos e patenteados em outros países. Certamente, um esforço no sentido do desenvolvimento desses e de novos antivirais em nível nacional seria um enorme passo!
Participam da pesquisa também:
Prof. Jerson Lima Silva e Prof. Andre M. O. Gomes, do IBqM e Prof. Theo L.F. Souza, da Faculdade de Farmácia da UFRJ, além da doutoranda Vanessa Braga.
Esse artigo recebeu a colaboração da Profa. Maria Lucia Bianconi, do IBqM e Prof. Davis Ferreira, do IMPPG, ambos da UFRJ, com o Dr.David Peabody da University of New Mexico, EUA, e com a Dra. Sheila Lima, egressa do Programa de Química Biológica e atualmente chefe do LATEV, Biomanguinhos, FIOCRUZ.
Créditos da imagem: Larissa Haerolde, Francisco Prosdócimi e Freepik
Recomendamos fortemente a leitura do artigo ”Charge neutralization as the major factor for the assembly of nucleocapsid-like particles from C-terminal truncated hepatitis C virus core protein" no site do periódico através do endereço eletrônico: https://peerj.com/articles/2670
Formato para citação:
* de Souza TL, de Lima SM, Braga VL, Peabody DS, Ferreira DF, Bianconi ML, Gomes AM, Silva JL, de Oliveira AC. Charge neutralization as the major factor for the assembly of nucleocapsid-like particles from C-terminal truncated hepatitis C virus core protein. PeerJ. 2016 Nov 9;4:e2670. PubMed PMID: 27867765; PubMed Central PMCID: PMC5111903.
Por Larissa Haerolde e Francisco Prosdocimi para o portal BIOQMED.