Orto-iminoquinona: uma molécula capaz de inibir agregação de fibras amiloides
Um dos principais fatores associados aos danos cognitivos causados por doenças neurodegenerativas, como as doenças de Parkinson e Alzheimer, é a formação de agregados de proteínas denominados amiloides. Esses agregados são tóxicos para as células e levam à morte de neurônios e quadros de inflamação, além de poderem ser propagados de células doentes para outras saudáveis. Diversas terapias têm sido propostas com intuito de inibir a formação desses agregados ou de diminuir a citotoxicidade destes através do remodelamento das estruturas fibrilares já depositadas. Compostos com a epigalocatequina-3-galato, uma catequina extraída da folha do chá verde, e a molécula sintética CLR01, são capazes de promover efeitos anti-amiloidogênicos através da ligação forte com resíduos de lisina das proteínas.
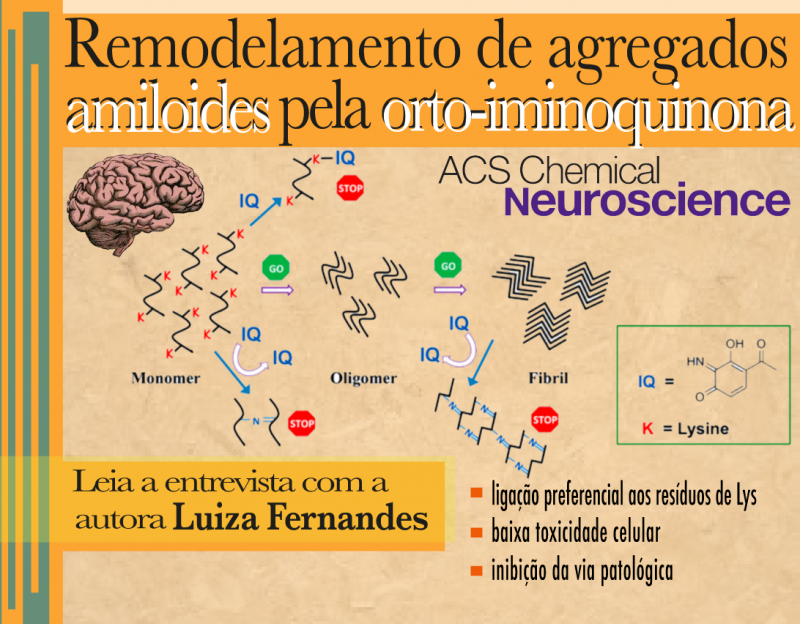
A doutoranda Luiza Fernandes (orientada pelo Prof. Fernando Palhano do IBqM) e outros pesquisadores publicaram, em 16 de Agosto de 2017, um artigo intitulado "An ortho-Iminoquinone Compound Reacts with Lysine Inhibiting Aggregation while Remodeling Mature Amyloids Fibrils". O trabalho foi capa do periódico ACS Chemical Neuroscience, um periódico da American Chemical Scociety. Nesse artigo, a proteína amiloide alfa-sinucleína, que está envolvida na Doença de Parkinson, foi utilizada como um dos principais modelos amiloides para testar os efeitos do composto orto-iminoquina sobre sua agregação. O trabalho demonstrou que a orto-iminoquinona, quando em contato com a alfa-sinucleína, interage com seus resíduos de lisina e promove a inibição da formação dos agregados, além de remodelar as fibras já maduras.
Os dados do artigo contribuem ao propor novos caminhos para o estudo de compostos capazes de reduzir a toxicidade de estruturas amiloidogênicas. Além disso, foram realizados testes em células neuronais e culturas de células HEK (células humanas embrionárias de rim) que demonstraram que o composto pode ser utilizado em altas concentrações, sem apresentar grande citotoxicidade. As perspectivas incluem a busca por um melhor esclarecimento sobre os mecanismos de ação da orto-iminoquina e moléculas similares para que mais adiante seja possível utilizá-las terapeuticamente.
A Doutoranda Luiza Fernandes esclareceu algumas questões de seu trabalho para o nosso portal, leia a seguir!
PORTAL BIOQMED. Bom dia, Luiza! A agregação proteica está envolvida em mecanismos de doenças neurodegenerativas como Doença de Alzheimer, afetando as sinapses. Vocês demonstraram que a molécula orto-iminoquinona (IQ) é capaz de inibir essa agregação. De que forma isso acontece? Quais características dessa molécula permitem que ela faça interações com agregados amiloides?
LUIZA FERNANDES. Esse composto foi sintetizado primeiramente por um outro grupo que tinha a ideia de utilizá-lo na síntese orgânica para produzir iminas. Mimetizando a ação de uma enzima, ele seria capaz de partir de aminas primárias livres para formar iminas de modo mais simples que os já existentes. Como nossas proteínas são compostas por aminoácidos e a lisina é um dos que possuem amina livre em seu radical, pensamos que o IQ pudesse se ligar as lisinas e formar iminas, evitando que as proteínas amiloides se estruturassem ou mesmo promovendo reorganização estrutural (remodelamento) da fibras amiloides maduras. As fibras são formadas a partir da proteína amiloide monomérica e os pequenos oligômeros primeiramente formados são ditos espécies mais tóxicas, que amadurecem até gerarem estruturas poliméricas maiores (as fibras) as quais são ricas em folhas-beta, muito estáveis e insolúveis, depositando-se nos tecidos. Neste trabalho, foi observada a capacidade da orto-iminoquinona em ligar-se às lisinas da alfa-sinucleína e assim inibir a formação dos agregados amiloides, além de ter sido capaz de remodelar a fibra madura.
PORTAL BIOQMED. Atualmente, compostos como epigalocatequina-3-galato (EGCG) são utilizados como soluções mais recorrentes afim de inibir esses agregados. A orto-iminoquinona é capaz fazer o mesmo com mais eficiência? Vocês realizaram ensaios com ambos compostos isoladamente. O que a diferencia a IQ da EGCG? Quais resultados observados quando comparados?
LUIZA FERNANDES. O EGCG é uma catequina extraída da folha do chá-verde. Existem vários estudos (alguns em proteínas amiloides) que mostram que ele é eficiente em reduzir a agregação amiloide. O mecanismo de ação desse composto, entretanto, ainda não foi completamente elucidado e sua ação em geral é atribuída às suas propriedades antioxidantes. Porém um dos trabalhos publicados pelo Prof. Fernando Palhano demostrou que mesmo quando a EGCG estava oxidada, ela era capaz de remodelar as fibras amiloides, diferente do esperado para um anti-oxidante. Além disso, nesse estudo foi demonstrado que uma das maneira pela qual o EGCG pode agir é através do crosslink feito com as lisinas ou sulfidrilas de proteínas amiloides. Vimos, que a orto-iminoquinona também é capaz de fazer ligação covalente com algumas lisinas da alfa-sinucleína e inibir a agregação. Uma das vantagens da IQ seria sua capacidade de agir de maneira cíclica, estando por mais tempo disponível para reação, porém ainda não conseguimos demonstrar essa capacidade de ligar e desligar das proteínas amiloides durante seu efeito inibitório sobre a agregação. Outra vantagem é a possibilidade de usar maiores concentrações da IQ comparado ao EGCG sem que seja tóxico para as células, conforme demonstramos em nosso estudo.
PORTAL BIOQMED. A orto-iminoquinona gera alguma toxicidade celular?
LUIZA FERNANDES. Nós tratamos culturas celulares de neurônios dopaminérgicos e de células HEK com diversas concentrações de IQ. Os resultados mostraram que, acima de 200uM, a IQ apresentou uma ligeira toxicidade. Mas conseguimos titular até 500uM sem causar elevada morte celular, diferente do EGCG que em baixas concentrações (50uM) já apresentava grande toxicidade para as mesmas células avaliadas.
PORTAL BIOQMED. O EGCG é usado no tratamento de doença de Parkinson?
LUIZA FERNANDES. Não, as pessoas ainda não usam como tratamento, mas existe estudos em laboratório de pesquisa mostrando que o EGCG é eficiente tanto em inibir a agregação de amiloide quanto em diminuir a citotoxicidade dos agregados. E já estão sendo realizados testes clínicos dessa molécula.
PORTAL BIOQMED. Como a orto-iminoquinona pode estar envolvida nas atividade de remodelação das fibrilas maduras?
LUIZA FERNANDES. Nossos resultados indicam que a IQ se liga à lisinas da fibra amiloide madura e modifica as propriedades características de um amiloide. É possível que, ao ligar na lisina, a IQ iniba ou altere alguma interação específica entre os aminoácidos da proteína e isso promova uma reorganização da fibra, que perde propriedades ditas características de agregados amiloidogênicos -- que estão envolvidos com o quadro clínico das doenças neurodegenerativas.
PORTAL BIOQMED. A lisozima é uma enzima de grande importância na defesa do organismo contra patógenos, atuando na degradação da parede celular de bactérias. O que foi avaliado quando essa enzima foi tratada juntamente com a orto-iminoquinona? E quanto a especificidade de orto-iminoquinona nos ensaios de competição?
LUIZA FERNANDES. Nós avaliamos a especificidade de ligação da IQ à alfa-sinucleína através do ensaio de competição. Colocamos diferentes quantidades de lisozima em concentrações equimolares de proteínas para ver se a IQ iria continuar inibindo a agregação da alfa-sinucleína por ligar-se preferencialmente à esta proteína ou se, alternativamente, ela iria deixar de inibir este processo por se ligar também à lisozima de modo inespecífico. Nossos resultados demonstraram que a IQ liga preferencialmente à alfa-sinucleína e parte desse efeito pode ter relação com a característica dessa proteína amiloide que é intrinsecamente desenovelada em sua forma nativa, tendo seus resíduos de lisina mais expostos que as lisinas presentes na lisozima. Nós utilizamos uma cepa de bactérias, o Micrococcus luteus, para avaliar se a IQ iria interferir na atividade enzimática da lisozima. A lisozima é uma enzima que promove lise (quebra) na parede celular de bactérias, levando-as à morte e o Micrococcus luteus é usado para avaliar essa atividade enzimática. No ensaio realizado neste trabalho observamos, conforme esperado, que a lisozima matou as bactérias e isso não foi alterado quando colocamos a lisozima com a alfa-sinucleína e a IQ. O que demonstra a preferência da IQ pela ligação com a alfa-sinucleína, sem levar à alteração da atividade da lisozima.
PORTAL IBQM. Quais as expectativas futuras para esse trabalho?
LUIZA FERNANDES. Nós pretendemos avançar na elucidação do mecanismo de ação da IQ, vimos que a IQ ligou preferencialmente à duas lisinas específicas da proteína (dados não publicados) e que, além de ligar às lisinas, ela também oxidou as metioninas da alfa-sinucleína, podendo ser essa uma parte da sua atividade anti-amiloidogênica. Um outro passo também importante para complementar o estudo é avaliar se a IQ é capaz de reduzir a toxicidade causada às células neuronais pelos oligômeros amiloides de alfa-sinucleína.
Recomendamos fortemente a leitura do artigo “An ortho-Iminoquinone Compound Reacts with Lysine Inhibiting Aggregation while Remodeling Mature Amyloid Fibrils” no site do periódico através do endereço eletrônico: http://pubs.acs.org/doi/abs/10.1021/acschemneuro.7b00017
Formato para citação:
*Fernandes L, Moraes N, Sagrillo FS, Magalhães AV, de Moraes MC, Romão L, Kelly J, Foguel D, Grimster NP, Palhano FL. An ortho Iminoquinone Compound Reacts with Lysine Inhibiting Aggregation while Remodeling Mature Amyloid Fibrils. ACS Chem Neurosci. 2017 Aug 16;8(8):1704-1712. doi: 10.1021/acschemneuro.7b00017. Epub 2017 May 4. PubMed PMID: 28425704.
Por Larissa Haerolde e Francisco Prosdocimi para o portal BIOQMED.