A interação entre o parasita e o barbeiro na doença de Chagas
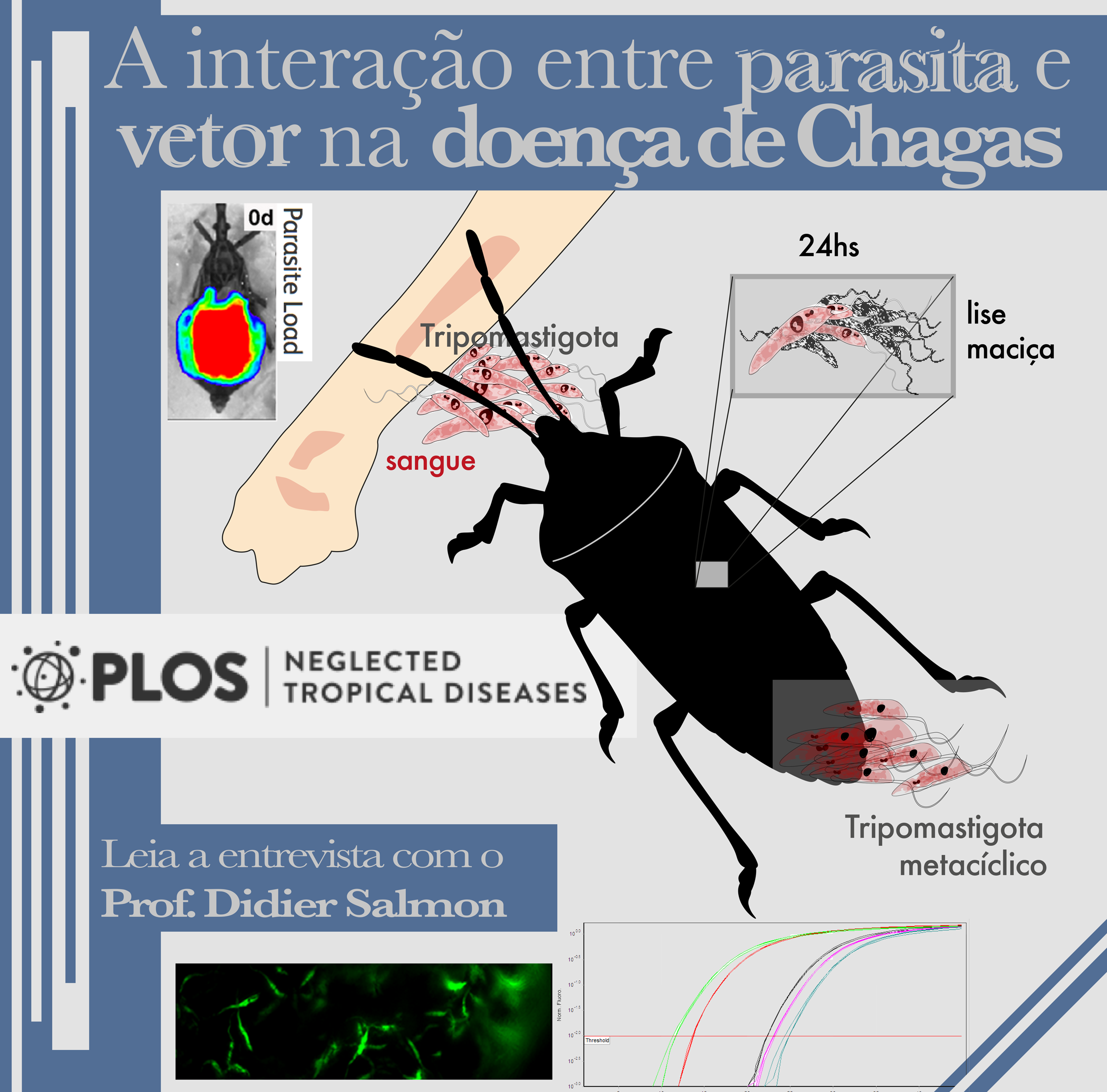
No dia 23 de Outubro de 2015, um grupo formado por vários alunos e professores do IBqM e coordenado pelo Prof. Didier Salmon publicou um artigo na revista PLoS Negleted Diseases apresentando uma nova visão sobre a dinâmica da colonização do parasita Trypanosoma cruzi no trato digestivo do barbeiro vetor Rhodnius prolixus. Esse barbeiro é o segundo maior transmissor da Doença de Chagas e este estudo revelou importantes características do ciclo de vida do T. cruzi, agente etiológico desta doença que, segundo dados oficiais da OMS ainda infecta de 6 a 7 milhões de pessoas na América Latina.
O portal BIOQMED não poderia deixar passar em branco a oportunidade de entrevistar nossos cientistas sobre essas novas descobertas e assim convidamos o Prof. Didier Salmon e o pós-doutorando Felipe de Almeida Dias para esclarecer alguns aspectos deste importante trabalho e divulgá-lo para um público mais amplo. Agradecemos de antemão ao professor pelas respostas fornecidas.
PORTAL BIOQMED. Bom dia, Prof. Didier. Obrigado por aceitar fazer essa entrevista. Vimos que sua pesquisa visou desvendar e descrever melhor o desenvolvimento e as interações do protozoário Trypanosoma cruzi com seu vetor. Quais são as principais características biológicas conhecidas dessas interações? Quais os novos dados revelados através da colonização do R. prolixus?
PROFESSOR DIDIER SALMON E DR. FELIPE DE ALMEIDA DIAS: Bom dia Larissa! Eu que lhe agradeço para me dar a oportunidade de falar sobre a nossa pesquisa. Apesar do Carlos Chagas ter descrito o ciclo de vida do T. cruzi há mais de um século, ainda se sabe muito pouco sobre muitos aspectos do ciclo de vida do parasita e ainda menos sobre o papel das interações que ocorrem durante o diálogo entre o parasita e seu vetor, o barbeiro (triatomíneo).
Basicamente, sabe-se que as formas que colonizam o intestino do barbeiro são capazes de interagir com as membranas perimicrovilares que recobrem as células intestinais e com a cutícula do reto onde ocorre a segunda parte do desenvolvimento do parasita, um processo chamado de metaciclogênese, no qual as formas epimastigotas se transformam em formas tripomastigotas metacíclicas, que são as formas infecciosas eliminadas com a urina e as fezes.
A novidade na história é o evento de lise maciça que ocorre durante as primeiras 24 horas após a ingestão do sangue, na parte anterior do intestino médio, onde cerca de 90% dos parasitas ingeridos morrem! Nós evidenciamos que este fenômeno não está relacionado à ação de bactérias naturalmente presentes no intestino do inseto (microbiota intestinal). A nossa hipótese é que este evento pode estar relacionado à liberação de um fator tripanolítico pelo inseto. Além disso, descobrimos que os parasitas que sobrevivem a este evento de lise, se multiplicam na forma de epimastigotas, se agregam para formar um tipo de “ninhos” na parede do intestino anterior e médio. Acreditamos que esses santuários de parasitas, são reservatórios “dormentes” do parasita que se multiplicam quando o inseto se alimenta novamente, e deste modo ajudam a manter infecção no vetor, que assim pode se manter infeccioso a vida toda.
PORTAL BIOQMED. Você poderia nos dizer como acontece a cinética da colonização parasitária no vetor? Em qual fase o parasito entra no hospedeiro e como ocorre a maturação dele ao longo do trato intestinal do barbeiro?
PROFESSOR DIDIER SALMON E DR. FELIPE DE ALMEIDA DIAS: O ciclo biológico de T. cruzi começa quando o inseto vetor se alimenta do sangue de um hospedeiro vertebrado infectado. Resumindo, durante a alimentação, as formas tripomastigotas no sangue do hospedeiro infectado, que são as formas infecciosas, são ingeridas pelo inseto. Na porção anterior do tubo digestivo, uma certa proporção das formas tripomastigotas que sobreviveram à lise (cerca de 10%) se transformam em epimastigotas que são formas replicativas que se multiplicam principalmente no intestino médio posterior. No reto, uma proporção das formas epimastigotas se transforma em tripomastigotas metacíclicos que são posteriormente eliminadas com as fezes que eventualmente infectam outro hospedeiro vertebrado. Todavia, o ciclo é bem mais complexo, pois existem outros estágios (formas esferomastigotas arredondadas, epimastigotas intermediarias) e ainda não se sabe como, nem quando, por exemplo, o evento de diferenciação está sendo disparado. Num outro trabalho recente, nós mostramos que a metaciclogênese parece depender da via de ativação da adenilato ciclase do parasita, mas o modo de ativação dessa enzima no trato digestivo do inseto ainda permanece um mistério.
PORTAL BIOQMED. Como funciona a infecção do barbeiro pelo T. cruzi? O seu artigo evidencia que há uma redução da carga parasitária durante as primeiras 24hs após a infecção. O T. cruzi gera alguma deficiência ou problemas visíveis para os barbeiros? A fisiologia, a bioquímica e a imunologia do hospedeiro dificultam a proliferação da colonização parasitária?
PROFESSOR DIDIER SALMON E DR. FELIPE DE ALMEIDA DIAS: Nós suspeitamos que o barbeiro não é tão tolerante ao parasita, e ele precisa controlar a carga parasitaria para manter a suas funções vitais e sua homeostase intestinal (digestão do repasto sanguíneo e absorção dos nutrientes, balanço oxidativo, etc). Como está sendo controlada essa carga parasitária? Bem é uma das perguntas que vamos tentar responder agora. Temos algumas ideias sobre os alvos potenciais, mas uma varredura usando uma biblioteca de bactérias produtoras de RNA de dupla fita seria provavelmente a melhor estratégia para resolver esse problema. Estas bactérias podem ser introduzidas no sangue que alimenta os barbeiros para inibir a expressão de genes específicos. Todavia, para ir adiante, já selecionamos vários genes candidatos do inseto para serem silenciados. Para avaliar o efeito do silenciamento gênico usaremos parasitas bioluminescentes expressando a enzima luciferase de vagalume para ter uma leitura instantânea da lise in situ entre 6h e 24h pós-infecção.
PORTAL BIOQMED. Você poderia nos explicar sobre como a metodologia de qPCR permite fazer a quantificação precisa do T. cruzi nos diferentes segmentos do trato digestivo do vetor? O que significa o fato de que determinadas regiões do intestino apresentam variações no nível parasitário? De que forma esses dados podem servir como ferramentas úteis?
PROFESSOR DIDIER SALMON E DR. FELIPE DE ALMEIDA DIAS: Bem, encontramos vários problemas para conseguir desenvolver uma metodologia de PCR quantitativa, reprodutível e altamente sensível. O tubo digestivo é um meio extremamente hostil para o desenvolvimento do parasita e isso se reflete nas variações de carga parasitaria ao longo do tempo. Nós conseguimos, após muitas tentativas infrutíferas, purificar o DNA livre de hemina/hemozoína e polissacarídeos (diminuem drasticamente o rendimento de DNA e inibe a reação da PCR). O protocolo de quantificação de parasitas se baseia na extração de DNA total dos três segmentos do intestino dos vetores infectados e da quantificação específica do DNA do parasita. Comparando as medidas de DNA dos parasitas presentes nas amostras de intestino do inseto com as medidas feitas a partir de extrações de DNA de quantidades conhecidas de parasitas (curva-padrão), e corrigindo esses valores de acordo com o rendimento das extrações usando um DNA externo como controle, nós conseguimos determinar o número exato de parasitas. Esses dados são úteis como referência da cinética de desenvolvimento do parasito no barbeiro e a técnica que desenvolvemos será crucial para investigar o papel dos genes que participam do diálogo entre o vetor e o parasita.
PORTAL BIOQMED. Segundo dados da literatura, existe uma alta variabilidade na taxa de infecção dos vetores entre países latino-americanos e que essa taxa pode ser de 5% no Brasil e até 79% na Bolívia. A que se deve a alta variação?
PROFESSOR DIDIER SALMON E DR. FELIPE DE ALMEIDA DIAS: Esta questão é complexa pois existem vários fatores que determinam a taxa de infecção nos insetos, entre eles as espécies de triatomíneos, os reservatórios circulantes, a microbiota dos triatomíneos, os ecótopos, etc mas nós achamos que essa taxa baixa em infecção chagásica em região endêmica deve ser em parte devida a essa lise que dificulta a colonização do inseto pelo parasita.
PORTAL BIOQMED. Na sua opinião, a doença de Chagas - responsável por aproximadamente 12,5 mil mortes por ano no mundo - tem suas medidas profiláticas negligenciadas pela saúde pública? Esses números podem ser explicados pela falta de conhecimento preciso da doença, pela falta de investimento do governo para pesquisas, pela dificuldade intrínseca no controle de qualquer doença ou por algum outro fator?
PROFESSOR DIDIER SALMON E DR. FELIPE DE ALMEIDA DIAS: O fato de que essa doença está intimamente relacionada à miséria certamente não representa um grande apelo para a criação de consórcios internacionais de luta integrada contra essa moléstia e para o investimento da indústria farmacêutica no desenvolvimento de drogas mais efetivas. Várias iniciativas dos programas de luta antivetorial contra o principal vetor Triatoma infestans (Iniciativa do Cone Sul) contribuíram para reduzir de maneira significativa a transmissão da doença em muitas áreas dos países do cone sul, mas a resistência crescente dos triatomíneos aos inseticidas, a presença de ciclos silváticos com miríades de vetores e reservatórios, tornou essa luta inapropriada, além de representar um desastre potencial para o meio ambiente. Obviamente o conhecimento íntimo dos mecanismos moleculares que participam das interações entre o parasita e seu vetor é fundamental para tentar descobrir novos caminhos de luta profilática contra essa moléstia. Mas, essa luta é extremamente complexa e multidisciplinar, envolvendo pesquisa básica sobre a doença, epidemiologia e controle da transmissão vetorial, ações em educação ambiental, melhoria das condições de habitação da população de risco, etc...
PORTAL BIOQMED. Recapitulando o título do seu artigo, temos uma pergunta final sobre ele. Quais foram os insights que o seu artigo forneceu sobre o ciclo de vida do T. cruzino trato intestinal do barbeiro?
PROFESSOR DIDIER SALMON E DR. FELIPE DE ALMEIDA DIAS: Os principais insights foram o evento de lise que mata mais de 90% dos parasitas nas primeiras 24 horas após a infecção dos insetos, a presença de um sistema de controle que balança a taxa relativa de formas epimastigotas e metacíclicos de maneira a otimizar a competência vetorial.
PORTAL BIOQMED. Vários alunos e professores de nossa pós-graduação em Química Biológica participam desta publicação. Foi difícil coordenar e organizar o trabalho de todos eles? O senhor poderia nos contar um pouco de como nasceu a ideia e como se deu seu desenvolvimento até a publicação do artigo?
PROFESSOR DIDIER SALMON: A ideia nasceu há muito tempo atrás, há mais de dez anos. Eu estava na procura de um fator de diferenciação dos parasitas presente dentro do trato digestivo do inseto. Foi, então, que percebi que para tal objetivo precisava de uma fotografia precisa das etapas chaves do processo de colonização do barbeiro e que isso faltava na literatura. Comecei a trabalhar com pesquisadores da Fiocruz, e na UFRJ me juntei naturalmente ao grupo liderado pelo Professor Pedro, que possui expertise na fisiologia e bioquímica desses insetos. Acho que a troca de idéias entre todos nos foi muito produtiva, pois temos maneiras diferentes, mas complementares, de abordar os diversos problemas aos quais somos confrontados. Como parasitologista vejo mais o lado do parasita, os meus colegas são especializados em imunidade inata e desafios ao estresse oxidativo no vetor.
PORTAL BIOQMED. Finalmente, sabemos que o senhor é um pesquisador europeu que veio trabalhar no Brasil. Você poderia nos dizer por que escolheu o Brasil e mais especificamente o Rio de Janeiro? O que o senhor pensa da universidade brasileira e das condições de se fazer ciência em nosso país?
PROFESSOR DIDIER SALMON: Acho que o que atrai o ser humano são desafios e ter liberdade para tentar realizá-los. Bem, neste ponto acho que o Brasil, em particular Rio de Janeiro, constitui um espaço muito favorável ao desenvolvimento do espírito pioneiro, inovador e criativo. Obviamente, como parasitologista em doenças tropicais, não tem como ter melhor ambiente, especialmente para se trabalhar com eco-epidemiologia que também é uma área que estou investigando atualmente.
Quanto as condições de se fazer ciência no Brasil, acho que existe um padrão de alta qualidade que está se espalhando pelo Brasil inteiro. A pesquisa se globalizou e o Brasil está participando de muitos programas de colaborações bilaterais e multilaterais internacionais. Apesar da situação de crise que o pais está enfrentando com significativos cortes dos investimentos em educação e ciência, temos de ir para frente para poder manter ambos a nossa produção científica e um ensino de qualidade, esperando sinais de melhora num futuro próximo.
Designed by FPROS with the great help of Larissa and Freepik!!
Recomendamos fortemente a leitura do artigo “Monitoring of the Parasite Load in the Digestive Tract of Rhodnius prolixus by Combined qPCR Analysis and Imaging Techniques Provides New Insights into the Trypanosome Life Cycle” no site do periódico através do endereço eletrônico: http://journals.plos.org/plosntds/article?id=10.1371/journal.pntd.0004186
Formato para citação:
* Dias Fde A, Guerra B, Vieira LR, Perdomo HD, Gandara AC, Amaral RJ, Vollú RE, Gomes SA, Lara FA, Sorgine MH, Medei E, de Oliveira PL, Salmon D. Monitoring of the Parasite Load in the Digestive Tract of Rhodnius prolixus by Combined qPCR Analysis and Imaging Techniques Provides New Insights into the Trypanosome Life Cycle. PLoS Negl Trop Dis. 2015 Oct 23;9(10):e0004186. doi:10.1371/journal.pntd.0004186. eCollection 2015 Oct. PubMed PMID: 26496442.
Por Larissa Haerolde e Francisco Prosdocimi para o portal BIOQMED.